Il laboratorio dello stress ossidativo
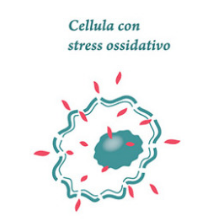
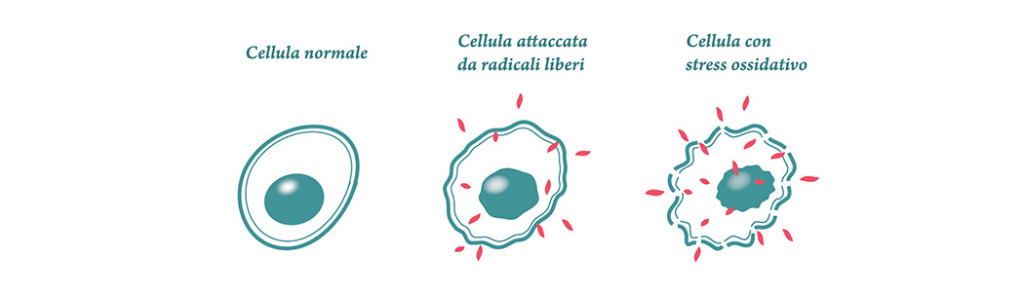
Il termine Stress Ossidativo o “squilibrio redox” indica l’insieme delle alterazioni che si producono nei tessuti, nelle cellule e nelle macromolecole biologiche allorchè queste sono esposte ad un eccesso di agenti ossidanti, tanto endogeni (ad es. quelli prodotti dalle cellule infiammatorie) quanto esogeni (i tossici ambientali) ed ha come effetto disfunzioni, danno cellulare, apoptosi o necrosi.
La grande varietà di meccanismi che uno squilibrio redox può generare rende conto di come le reazioni dello stress ossidativo possano partecipare alla patogenesi. Negli ultimi anni è stata particolarmente studiata l’implicazione di queste alterazioni in patologie a base infiammatoria, insufficienza renale cronica, diabete, ischemia, malattie cardiovascolari e patologie neurodegenerative.
Nel considerare il significato delle reazioni ossidative che compaiono durante un processo patologico è difficile concludere se esse siano la causa iniziale, se partecipino soltanto ai meccanismi patogenetici o se compaiano come effetto finale del processo.
La comprensione del preciso ruolo dello Stress Ossidativo ha ricadute immediate sull’atteggiamento terapeutico: nel ruolo causale e patogenetico le reazioni ossidative andranno contrastate (ad es. mediante somministrazione di antiossidanti) mentre nel ruolo di marcatore avranno importanza diagnostica e prognostica.
Tra le numerose patologie oggetto di studio, particolare rilievo è dato alle alterazioni neurodegenerative in quanto il sistema nervoso centrale è molto vulnerabile ai processi ossidativi a causa dell’elevata quantità di ossigeno richiesta dal metabolismo neuronale, dell’elevato contenuto di acidi grassi insaturi facilmente aggredibili dalla perossidazione (fosfolipidi di membrana) e dei significativi depositi di metalli redox-attivi quali ferro e rame.
Anche se è poco probabile che lo Stress Ossidativo rappresenti l’evento primario del processo neurodegenerativo è stato accertato che nel corso della malattia si verificano processi ossidativi che partecipano in modo sostanziale alla progressione del danno neuronale. Perciò, se è fuorviante pensare allo Stress Ossidativo come l’origine di tutti i processi patologici nei quali si manifesta è certo sensato considerarlo come uno degli anelli importanti della catena patogenetica.
Controllare i livelli di Stress Ossidativo, o squilibrio redox, anche quando questo non sia la causa iniziante della malattia, può consentire di interrompere la catena e limitare la progressione del danno(Figura 2).
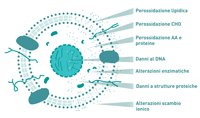
Poichè l’analisi diretta dei ROS/RNS è estremamente difficile a causa della loro elevata reattività e breve emivita (10-5, 10-6 e 10-9 secondi rispettivamente per il radicale superossido, l’ossigeno singoletto e il radicale idrossile), lo studio dello stress ossidativo si avvale principalmente di metodi in grado di rilevare le alterazioni da essi indotte su proteine, lipidi e DNA.
Sebbene più soggette alle interferenze della dieta, anche le diminuzioni delle molecole con capacità antiossidante, quali vitamine lipo- ed idro-solubili e glutatione sono considerate marcatori indiretti di stress ossidativo.
Le tecniche analitiche utilizzate spaziano dai più semplici saggi spettrofotometrici alle più complesse analisi cromatografiche (Figura 3).
Il processo di ossidazione delle proteine comporta generalmente l’introduzione di nuovi gruppi funzionali che possono contribuire ad alterarne la funzione ed il metabolismo. Il destino delle molecole alterate è generalmente la degradazione da parte del proteosoma o dei lisosomi, ma in alcuni casi si formano aggregati che si accumulano all’esterno della cellula e sono insensibili alla degradazione.
Principali biomarcatori di ossidazione delle proteine sono: i gruppi carbonilici, i prodotti di ossidazione della tirosina come la 3-nitrotirosina (3-NT); altri sono oggetto di studio quali gli idroperossidi e perossidi proteici di valina, leucina, lisina, la chinurenina, la metionina-sulfossido e la metionina-sulfone, i disolfuri della cisteina (Figura 4).
I fosfolipidi di membrana e i trigliceridi nelle LDL sono particolarmente suscettibili all’attacco radicalico. Gli idroperossidi lipidici che originano da una prima reazione che causa il riarrangiamento molecolare a livello dei doppi legami, sono a loro volta specie reattive che possono ulteriormente reagire a formare perossidi ciclici ed aldeidi alfa-beta-insature come la malondialdeide (MDA) e la 4-idrossi-nonenale (4-HNE).
Poichè idroperossidi ciclici ed aldeidi possono essere assorbiti anche con la dieta, la misura di queste specie costituisce un buon indice di lipoperossidazione solo in presenza di uno stretto controllo della dieta.
Una particolare classe di composti generati dalla lipoperossidazione a carico dell’acido arachidonico, gli isoprostani, per effetto della loro stabilità ed indipendenza dalla dieta sono stati proposti come marcatore di riferimento: poichè essi possono essere però analizzati soltanto mediante cromatografia liquida associata alla spettormetria di massa il loro impiego, allo stato attuale, risulta problematico (Figura 5).
L’attacco delle ROS, in particolare del radicale idrossile, sugli acidi nucleici può causare mutazioni su specifiche basi e anche rottura della doppia elica.
Il marcatore di danno ossidativo sul DNA più utilizzato è la 8-idrossi-deossiguanosina (8-OHdG). Durante il processo di riparazione in vivo del DNA e soprattutto in seguito alla degradazione degli acidi nucleici conseguente alla morte cellulare, la 8-OHdG viene liberata e secreta nelle urine, sia come base singola sia inclusa in oligomeri di DNA senza ulteriori modifiche. Data la stabilità e la specificità, la concentrazione di 8-OHdG nelle urine è uno dei più affidabili marcatori per valutare il grado di stress ossidativo sistemico (Figura 6).
Esistono in vivo sistemi enzimatici (superossidodismutasi, catalasi, perossidasi, reduttasi) e non enzimatici endogeni (antiossidanti a basso peso molecolare quali glutatione, NADH, acido urico, melatonina, acido alfa-lipoico) ed esogeni (vitamine A, E, C, chinoni, polifenoli) in grado di contrastare fisiologicamente ROS e RNS.
Lo Stress Ossidativo ed i suoi effetti patologici intervengono nel momento in cui il rapporto di produzione dei radicali liberi e loro neutralizzazione si sbilancia a favore dei primi.
Sul principio del potenziamento della barriera antiossidante tramite il controllo di diete, stili di vita e/oo somministrazione di nutraceutici si fondano le strategie di intervento volte a contrastare, ma soprattutto prevenire, gli eventi patologici (Figura 7).
Come frequentemente accade in medicina di laboratorio, nessuno dei biomarcatori attualmente disponibili risponde singolarmente ai criteri di idealità (stabilità, specificità d’organo o di patologia, sensibilità e specificità di analisi, bassa variabilità biologica, non influenza di fattori dietetici) (Figure 8-9). Alcuni tra i marcatori proposti sono importanti solo se opportunamente contestualizzati (Figura 10).
E’ questo il caso della 8-OHdG i cui livelli di concentrazione, come dimostrato in un nostro precedente studio, possono evidenziare differenze statistiche significative tra gruppi solo se rapportati alla concentrazione della corrispondente base azotata non modificata, la 2-deossiguanosina (Figura 11).
Quale strategia dunque è consigliabile adottare? Data la molteplicità dei bersagli delle ROS/RNS ed il complesso metabolismo al quale vanno incontro i prodotti delle loro reazioni è però verosimile che l’insieme di più marcatori sia più informativo che uno solo, anche in virtù del fatto che ciascuno rispecchia una sfaccettatura dell’intero fenomeno (Figura 12).
Dopo un attento esame della significatività di vari marcatori proposti dalla più recente letteratura, intesa soprattutto come specificità ed affidabilità analitica (Figura 13), nel nostro laboratorio abbiamo elaborato un pannello di test in grado di descrivere efficacemente il quadro redox del paziente.
Esso, oltre a test di screening di valutazione complessiva del potenziale ossidante ed antiossidante ed a test in grado di evidenziare la presenza di generici stati infiammatori, comprende marcatori specifici di perossidazione delle principali molecole (lipidi, proteine, DNA) e singole molecole ad effetto pro-ossidante e riducente. La disponibilità di test di screening e di test specifici di approfondimento permette al clinico di graduare l’approccio(Figure 14-17).
Oltre a questo pannello è stato pensato un ulteriore gruppo di accertamenti che rappresenta uno step di approfondimento nei casi di Stress Ossidativo conclamato: esso è costituito da test utili per l’individuazione degli stati carenziali ed ha lo scopo di coadiuvare nella correzione degli stili di vita e nella pianificazione di eventuali interventi terapeutici o nutraceutici (Figura 18).
E’ ragionevole, in conclusione, prevedere che il futuro dei marcatori di stress sarà molto probabilmente determinato da due distinte direttrici: l’una, rappresentata dalla ricerca clinica che secondo i criteri della Evidence Based Medicine (EBM) definirà l’appropriatezza di ciascuno di essi; l’altra, supportata dalla sempre maggiore applicazione di metodi analitici ad elevatissime prestazioni: questi ultimi, in particolare genomica, proteomica, metabonomica e metabolomica sono in grado di fornire analisi che mirano a rappresentare la condizione fisio-patologica degli organismi utilizzando non più singoli marcatori ma interi e complessi pannelli (Figura 19).