Parkinson e Stress Ossidativo
(prof. G. Nordera)
La malattia di Parkinson (MP) è la seconda più comune malattia neurodegenerativa dopo la malattia di Alzheimer: colpisce la popolazione ad un’età media di 55 anni, è più comune sopra i 60 anni, ma molti casi sono diagnosticati già intorno ai 40 anni o anche al di sotto.
Negli USA la sua prevalenza è di 329/100.000 abitanti (Strikland Mov. Dis. 2004) ma si stima sia in aumento, tanto che si presume possa raddoppiare negli over 50 nei prossimi 25 anni (Dorsey et al. Neurology 2007) (Figura2).
La prevalenza in Italia è di 104/100,000 (95% CI 59.4-170.7) nella popolazione generale e di 422/100,000 nella popolazione con eta> 60 anni (Morgante et al, Parkinsonism related disorders, 2008): si stima che attualmente ci siano 250.000 persone affette in tutta la nazione e che 8-9000 risiedano in Veneto.
La malattia di Parkinson è causata da lesioni cerebrali delle cellule dopaminergiche all’interno della substantia nigra (SN) (Figura3) che va incontro ad una progressiva degenerazione (perdita di cellule pigmentate, corpi di Lewy) con conseguente decremento della produzione di dopamina (Figura4). La malattia si manifesta con caratteristiche alterazioni della deambulazione e posturali, tremore, rigidità, acinesìa, instabilità posturale(Figura5).
L’esordio della malattia si registra solo dopo parecchio tempo (4-5 anni) dal suo effettivo inizio (Figura6). La noxa patogena che causa la malattia è sconosciuta: ad oggi sono state identificate 13 mutazioni genetiche causali, a penetranza variabile, responsabili del 20% dei casi di malattia ma si ipotizza che l’interazione di fattori genetici ed ambientali sia necessaria per determinarne l’insorgenza (Figura7).
Tra i meccanismi etiopatogenetici ipotizzati sono lo Stress Ossidativo, l’alterazione della funzione mitocondriale, i fattori eccitotossici, i meccanismi infiammatori, la disfunzione del sistema ubiquitina-proteosomi, un anomalo accumulo di aggregati proteici, la carenza di fattori trofici e l’apoptosi, meccanismo di morte prematura del neurone dopaminergico(Figura8). Sembra quindi esistere uno stretto legame tra la malattia di Parkinson e Stress Ossidativo.
Non sembra però che vi sia un unico fattore prevalente ma è più probabile che questi fattori interagiscano tra di loro nel determinare la neurodegenerazione (Przedborski S. 2005).
Proprio per la molteplicità dei meccanismi etiopatogenetici coinvolti, la terapia della malattia di Parkinson ricorre a varie startegie: antiossidanti (inibitori MAO-B, scavenger dei radicali liberi, inibitori della sintesi del monossido di azoto), enhancer mitocondriali, anti eccitotossici, fattori trofici, inibitori del misfolding e dell’aggregazione proteica, antinfiammatori, antiapoptotici (Figura9).
Lo Stress Ossidativo rappresenta uno dei principali meccanismi patogenetici di morte neuronale nella MP: infatti il danno dei neuroni della SN si origina come conseguenza di una iperproduzione di radicali liberi nel corso del metabolismo ossidativo della dopamina. Tre fattori endogeni, isolatamente o in concorso, possono promuovere un’eccessiva produzione di radicali liberi e quindi comportare uno Stress Ossidativo: l’aumentato metabolismo della dopamina nei neuroni residui della SN, il deficit di glutatione ridotto (GSH) e l’eccessiva concentrazione di ioni Fe2+, che in presenza di H2O2, favorisce la formazione di radicale ●OH.
L’aumentata produzione di radicali liberi concorre ad incrementare l’aggregazione della sinucleina ed altre proteine malripiegate (Figura10).
Le cause di iperproduzione di radicali possono inoltre essere di natura ambientale (radiazioni ionizzanti, raggi UV, fumo di sigaretta, inquinanti), metabolica ed infiammatoria (Figura11).
L’impiego della terapia a base di L-DOPA riduce la sintomatologia nella MP ma non ne arresta la progressione: l’intervento terapeutico finalizzato a rallentare od arrestare il progredire della malattia prevenendo l’ulteriore degenerazione neuronale va sotto il nome di neuroprotezione ed i suoi meccanismi sono da tempo oggetto del nostro studio (Figura12).
La neuroprotezione non è una strategia volta a rimuovere le cause della malattia stessa, ma ad intervenire sui meccanismi patogenetici della morte dei neuroni della SN modificando la storia naturale della malattia. Con il termine neurorescue si indica il recupero della funzionalità dei neuroni in via di degenerazione ma non ancora morti mentre con neurorestoration si intende un intervento che mira ad incrementare il numero dei neuroni dopaminergici attraverso l’impianto diretto di nuovi neuroni o favorendo la proliferazione di quelli residui.
Una serie di ragioni, come la complessità dei meccanismi di morte cellulare, la non riproducibilità dei modelli animali, la lentezza di progressione della malattia, rendono molto difficile distinguere tra gli effetti terapeutici sintomatici e quelli neuroprotettivi (Figura13).
Un gruppo americano nel 2003 ha pubblicato l’elenco di 12 farmaci considerati neuroprotettivi (Figura14): si osservi che ben 5 di essi hanno effetto antiossidante. Tra questi anche il coenzima Q10, precedentemente utilizzato in un trial clinico pubblicato nel 2002: il 47% dei malati di Parkinson trattati con 1200 mg/die di coenzima Q10 hanno dimostrato un miglioramento della sintomatologia (scala UPDRS) rispetto ai trattati con placebo (Figura15). Un analogo studio condotto in Germania su una coorte più numerosa e pubblicato nel 2007 non ha invece dimostrato sostanziali differenze tra i trattati e i pazienti in placebo ((Figure16.17)).
Un recente studio cinese ha dimostrato un effetto neuroprotettivo determinato dal consumo di the e caffè (Figura18). Anche se a tale riguardo non sono state fornite dettagliate spiegazioni biochimiche, è ben noto che il preladenant, derivato della caffeina antagonista dei recettori A2A dell’adenosina (distribuiti in aree cerebrali dove modulano la trasmissione GABA-ergica, colinergica e glutammatergica) ha dimostrato effetti di miglioramento dei sintomi della MP (Figura19).
Da alcuni anni è oggetto di studio l’impiego nella MP degli antiossidanti naturali contenuti in alcuni alimenti come i polifenoli e il gallato di epigallocatechina (Figura20): tra questi la papaia fermentata (FPP), prodotta in Giappone secondo processi desunti dalla medicina tradizionale orientale e commercializzata in Italia da Named con il nome di Immun’Age®(Figura21).
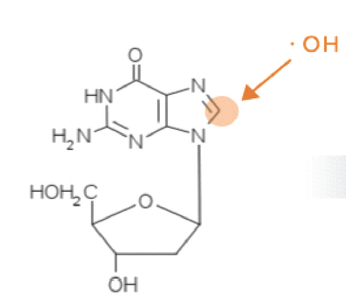
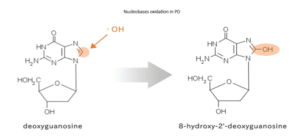
L’FPP contiene prevalentemente carboidrati, poche proteine, numerosi aminoacidi e alcuni oligoelementi. Studi in vitro e su animali hanno dimostrato che il composto possiede un’azione antiossidante che si evidenzia principalmente attraverso l’attivazione dell’enzima superossidodismutasi (SOD) (Imao et al. Biochem Med Biol INT, 1998) e la riduzione della concentrazione urinaria della la 8-idrossideossiguanosina (8-OHdG), maggiore prodotto del danno ossidativo a carico del DNA (Figura22).
E’ stato anche dimostrato che nella MP la concentrazione di 8-OHdG è aumentata rispetto ai controlli e presenta un progressivo incremento in relazione all’evoluzione della malattia (Sato et al, Neurology, 2005).
In uno studio su ratti parkinsonizzati, la somministrazione preventiva di FPP ha dimostrato la riduzione della perdita di cellule TH+ (Tirosina idrossilasi positive), capaci di trasformare la tirosina in L-Dopa (Datla et al. J Phar, Pharmacol, 2004).
Presso la Casa di Cura Villa Margherita è stato condotto un primo studio sulla MP trattata con FPP che aveva come obiettivo primario la valutazione dell’effetto clinico e della tollerabilità della FPP associata a terapia con L-Dopa o dopaminoagonisti in pazienti con fluttuazioni motorie e come obiettivo secondario la valutazione del possibile effetto neuroprotettivo della FPP(Figure23-25). A fronte di un miglioramento lieve delle scale di qualità di vita (in particolare degli score relativi alla “fatica”), lo studio ha evidenziato un miglioramento statisticamente significativo nelle scale motorie e una riduzione dei valori urinari di 8-OHdG, che si mantiene anche dopo un mese dalla sospensione del farmaco (Figure 26-28).
Attualmente stiamo conducendo un nuovo studio con FPP (Figura30) che oltre ad adottare un dettagliato programma di valutazione degli outcome (Figura31) si propone di valutare un esteso pannello di marcatori dello stress ossidativo e della barriera endogena antiossidante(Figura32) al fine di accertarne le eventuali modificazioni e le significatività relative dei singoli parametri.
Numerose evidenze cliniche suggeriscono dunque che la FPP può apportare dei miglioramenti al sistema immunitario ed aiuti a contrastare numerose patologie. Sono però necessari ulteriori approfondimenti per verificare l’efficacia della FPP nel prevenire o attenuare le patologie secondarie allo Stress Ossidativo quali la Malattia di Parkinson(Figura33).